KIMIA "Konfigurasi elektron"
Konfigurasi elektron merupakan suatu cara penulisan yang menunjukkan distribusi elektron dalam orbital-orbital atom. Penulisan konfigurasi elektron mengikuti beberapa aturan yaitu aturan Aufbau, asas Larangan Pauli dan aturan Hund. Setiap orbital pada setiap subkulit maksimal ditempati oleh dua elektron, yaitu:
Subkulit s terbuat dari 1 orbital s dan ditempati oleh 2 elektron\
Sub kulit p terbuat dari 3 orbital p dan ditempati oleh 6 elektron
Subkulit d terbuat dari 5 orbital d dan ditempati oleh 10 elektron
Subkulit f terbuat dari 7 orbital f dan ditempati oleh 14 elektron
Subkulit hanya sampai f karena sampai saat ini konfigurasi elektron untuk unsur dengan nomor atom tertinggi hanya sampai subkulit f.
Subkulit s terbuat dari 1 orbital s dan ditempati oleh 2 elektron\
Sub kulit p terbuat dari 3 orbital p dan ditempati oleh 6 elektron
Subkulit d terbuat dari 5 orbital d dan ditempati oleh 10 elektron
Subkulit f terbuat dari 7 orbital f dan ditempati oleh 14 elektron
Subkulit hanya sampai f karena sampai saat ini konfigurasi elektron untuk unsur dengan nomor atom tertinggi hanya sampai subkulit f.
Konfigurasi elektron dalam atom menggambarkan lokasi semua elektron menurut orbital-orbital yang ditempati. Pengisian elektron dalam orbital-orbital mengikuti aturan-aturan berikut.
1. Prinsip Aufbau
Elektron akan mengisi orbital atom yang tingkat energi relatifnya lebih rendah dahulu baru kemudian mengisi orbital atom yang tingkat energinya lebih tinggi.
Untuk memberikan gambaran yang jelas bagaimana susunan tingkat energi itu, serta cara penamaannya, dapat dilihat pada bagan di bawah ini.
Elektron akan mengisi orbital atom yang tingkat energi relatifnya lebih rendah dahulu baru kemudian mengisi orbital atom yang tingkat energinya lebih tinggi.
Untuk memberikan gambaran yang jelas bagaimana susunan tingkat energi itu, serta cara penamaannya, dapat dilihat pada bagan di bawah ini.
Untuk memudahkan urutan pengisian tingkat-tingkat energi orbital atom diperlukan bagan berikut.
2. Aturan Hund
Pada pengisian orbital-orbital yang setingkat, elektron-elektron tidak membentuk pasangan lebih dahulu sebelum masing-masing orbital setingkat terisi sebuah elektron dengan arah spin yang sama.
Untuk mempermudah penggambaran maka orbital dapat digambarkan sebagai segi empat
sedang kedua elektron yang berputar melalui sumbu dengan arah yang berlawanan digambarkan sebagai 2 anak panah dengan arah yang berlawanan,+ 1/2 (searah dengan arah putaran jarum jam) digambarkan anak panah ke atas,
– 1/2 (berlawanan dengan arah putaran jarum jam) digambarkan anak panah ke bawah.
Untuk elektron tunggal pada orbital s tidak masalah +1/2 atau – 1/2,tetapi jika orbital s tersebut terisi 2 elektron, maka bilangan kuantum spinnya harus + 1/2 dan – 1/2.
Demikian pula untuk pengisian orbital p (l = 1), elektron pertama dapat menempati orbital px, py, atau pz. Sebab ketiga orbital p tersebut mempunyai tingkat energi yang sama.
orbital s dengan elektronnya digambar
orbital p dengan elektronnya digambar
orbital d dengan elektronnya digambar
Contoh:
Perjanjian:
Pada pengisian elektron dalam orbital, elektron pertama yang mengisi suatu orbital ialah elektron yang mempunyai harga spin +1/2 dan elektron yang kedua mempunyai harga spin – 1/2 .
Berdasarkan pada tiga aturan di atas, maka kita dapat menentukan nilai keempat bilangan kuantum dari setiap elektron dalam konfigurasi elektron suatu atom unsur seperti pada tabel berikut ini.
Orbital penuh dan setengah penuh
Konfigurasi elektron suatu unsur harus menggambarkan sifat suatu unsur. Hasil eksperimen menunjukkan bahwa sifat unsur lebih stabil apabila orbital dalam suatu atom unsur terisi elektron tepat 1/2 penuh atau tepat penuh, terutama orbital-orbital d dan f (5 elektron atau 10 elektron untuk orbital-orbital d dan 7 elektron atau 14 elektron untuk orbital-orbital f).
Apabila elektron pada orbital d dan f terisi elektron 1 kurangnya dari setengah penuh/penuh, maka orbital d/f tersebut harus diisi tepat 1/2 penuh/tepat penuh. Satu elektron penggenapnya diambil dari orbital s yang terdekat.
Contoh:
Konfigurasi elektron ion positif dan ion negatif
Misalnya konfigurasi elektron ion K+; dan ion Cl–;
19K: 1s² 2s² 2p6 3s² 3p6
Bila atom K melepaskan 1 elektron maka terjadi ion K+ yang mempunyai jumlah proton 19 dan elektron 19 – 1 = 18
Konfigurasi elektron ion K+;: 1s² 2s² 2p6 3s² 3p6
17Cl: 1s² 2s² 2p6 3s² 3p5
Bila atom Cl menerima 1 elektron maka terjadi ion Cl&sup-; yang mempunyai jumlah proton 17 dan elektron 17 + 1 = 18
Konfigurasi elektron ion Cl–: 1s² 2s² 2p6; 3s² 2p5;
Konfigurasi elektron ion K+ = ion Cl– = atom Ar, peristiwa semacam ini disebut isoelektronis.
Konfigurasi elektron yang tereksitasi
Konfigurasi elektron yang telah dibicarakan di atas adalah konfigurasi elektron dalam keadaan tingkat dasar. Konfigurasi elektron yang tereksitasi adalah adanya elektron yang menempati orbital yang tingkat energinya lebih tinggi.
Contoh:
3. Larangan Pauli
Menurut prinsip ini dalam suatu atom tidak boleh ada 2 elektron yang mempunyai keempat bilangan kuantum yang sama harganya, jika 3 bilangan kuantum sudah sama, maka bilangan kuantum yang keempat harus berbeda.
Contoh:
Ternyata elektron ke-1 dan ke-2 mempunyai harga n, l, dan m yang sama, tapi harga s-nya berbeda. Elektron ke-3 tidak dapat menempati orbital1s lagi, sebab jika elektron ke-3 menempati orbital 1s, maka harga n, l, m, dan s elektron ke-3 akan sama dengan elektron ke-1 atau elektron ke-2.
Dengan menggunakan prinsip eksklusi Pauli dan ketentuan harga m dan l yang diperbolehkan untuk setiap harga n dapat disusun berbagai kombinasi 4 bilangan kuantum pada setiap kuantum grup sebagai berikut.
Kesimpulan:
Sesuai dengan prinsip eksklusi Pauli ini dapat disimpulkan bahwa dalam tiap orbital hanya dapat terisi 2 buah elektron.
Menulis Konfigurasi Elektron
Konfigurasi elektron dapat ditulis berdasarkan urutan dari Aufbau atau dapat disingkat menggunakan konfigurasi elektron gas mulia. Singkatan ini dilakukan agar penulisan konfigurasi elektron tidak terlalu panjang lagipula dalam pembentukan ikatan kimia elektron valensi lebih berperan, sedangkan elektron-elektron yang lebih dekat ke inti tidak begitu berpengaruh dalam pembentukan ikatan kimia.
Misalnya:
10Ne = 1s2 2s2 2p6
11Na = 1s2 2s2 2p6 3s1 atau (Ne) 3s1
Konfigurasi elektron ion
kation bermuatan y+ terbentuk jika atom netralnya melepaskan y elektron. Elektron yang dilepas merupakan elektron dari kulit terluar.
21Sc = (Ar) 3d1 4s2
Sc3+ = (Ne) 2s2 2p6
26Fe = (Ar) 3d6 4s2
Fe2+ = (Ar) 3d6
Fe3+ = (Ar) 3d5
Anion bermuatan y- terbentuk dari atom netralnya dengan menyerap y elektron. Elektron yang diserap itu mengisi orbital dengan tingkat energi terendah yang belum penuh.
17Cl = (Ne) 3s2 3p5
17Cl- = (Ne) 3s2 3p6
Bentuk Orbital
1) Orbital s
Bentuknya berupa bola simetris dan hanya memiliki 1 macam orbital. Semakin besar nilai n , maka ukurannya juga semakin besar.
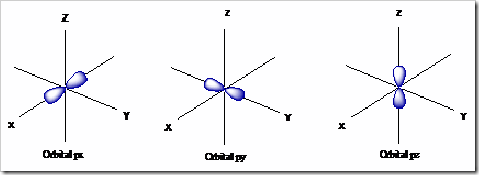
2) Orbital p
Orbital ini berjumlah 3 buah yang terletak di subkulit p. Ketiganya mempunyai tingkat energi yang sama, namun arah ruang/orientasinya berbeda (meliputi = px, py dan pz). Setiap orbital berbentuk seperti balon terpilin yang digambarkan menggunakan koordinat Cartesius dengan sumbu x, y dan z.
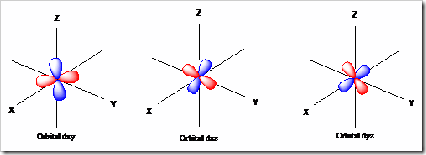
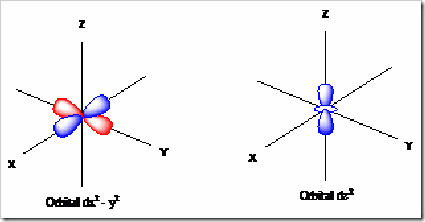
3) Orbital d
Orbital ini terletak di subkulit d dan terdiri dari 5 macam ( meliputi = dxy, dxz, dyz, dx2 – y2, dz2 ). Bentuk orbital ini dapat digambarkan sebagai 4 buah balon terpilin pada koordinat Cartesius.
Keterangan :
Orbital dxy = cuping-cupingnya terletak di antara sumbu x dan y
Orbital dxz = cuping-cupingnya terletak di antara sumbu x dan z
Orbital dyz = cuping-cupingnya terletak di antara sumbu y dan z
Orbital dx2 – y2 = cuping-cupingnya terletak pada sumbu x dan y
Orbital dz2 = terdiri dari 1 balon terpilin yang terletak pada sumbu z dan 1 daerah
berbentuk donat yang terletak pada bidang xy
sekian dulu pembahasan kali ini sampai jumpa pada postingan selanjutnya.





















Komentar
Posting Komentar